Atombau und Periodensystem
Geschichte
Demokrit (400 v. Chr.)
- Atome sind die kleinsten, unteilbaren Teilchen
- griech. atomos = unteilbar
John Dalton (1803)
- Atome sind unzerstörbar
- es gibt so viele Atomarten wie Elemente
- Atome werden bei chemischen Reaktionen neu zusammengesetzt
- Atome verschiedener Elemente unterscheiden sich in Größe und Masse voneinander
Joseph Thomson (1897) - Rosinenkuchenmodell
- es gibt negativ geladene Elektronen
- Atome sind nicht unteilbar
- Elektronen können aus Atomen entfernt werden
- Elektronen sind in positive Grundmaterie eingelagert
- Atome erscheinen nach außen hin neutral
- bei Abgabe und Aufnahme von Elektronen entstehen Ionen
Ernest Rutherford (1911) - Kern-Hülle-Modell
- Hülle ist 100000mal größer als der Kern
- Atomkern enthält positiv geladene Protonen
- Atomkern ist massig und lenkt α-Teilchen ab
Niels Bohr (1913) - Schalenmodell
- negative Elektronen bewegen sich auf Bahnen um den massigen Atomkern
- beim Bahnwechsel wird ΔE aufgenommen oder abgegeben
Erwin Schrödinger (1926)
- Orbitale sind Orte mit hoher Aufenthaltswahrscheinlichkeit der Elektronen
- Elektronen lassen sich durch vier Quantenzahlen beschreiben
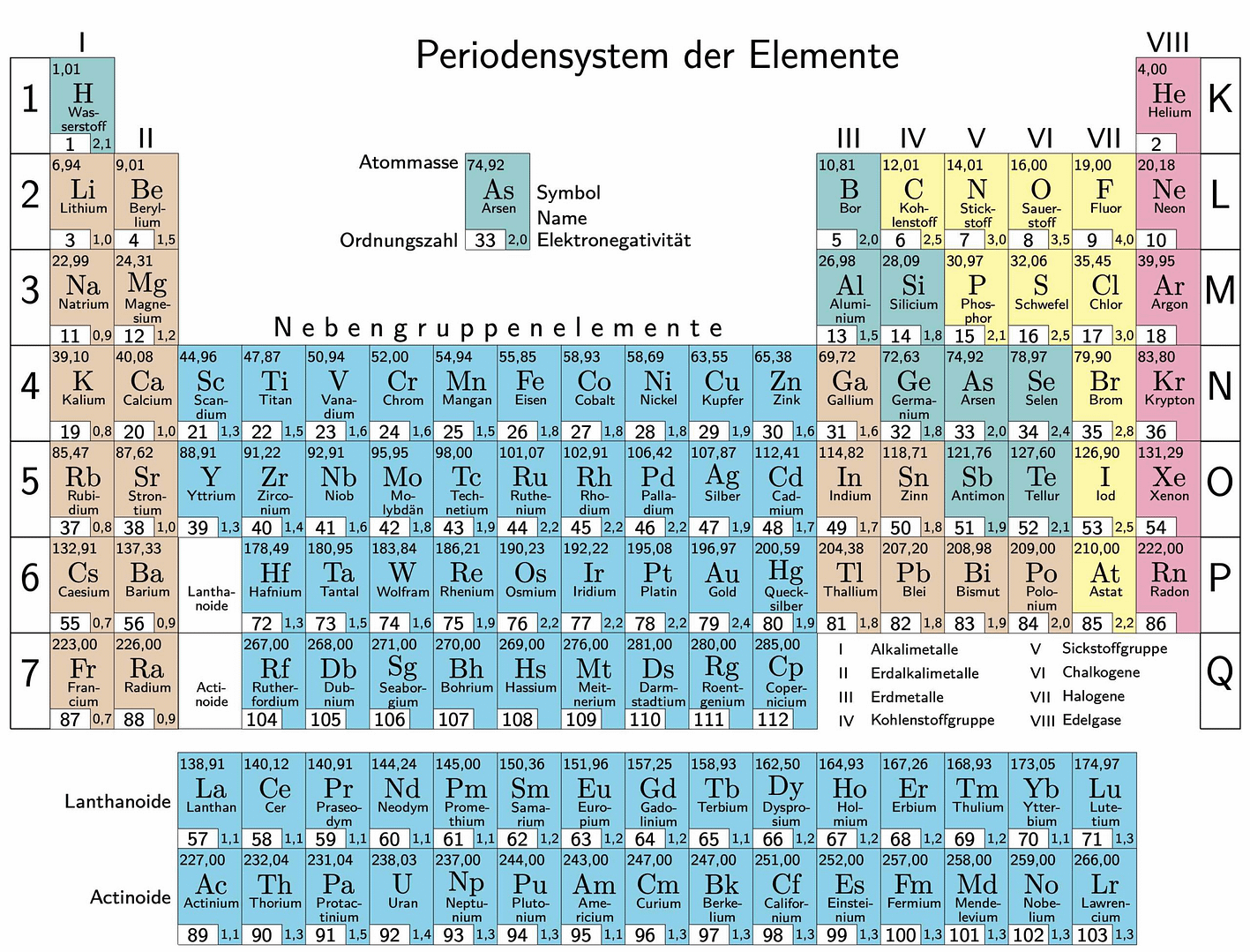
Periodensystem der Elemente
Viele Informationen über den Atombau lassen sich dem Periodensystem der Elemente entnehmen. So entspricht die Ordnungszahl Z der Protonenzahl und somit auch bei Atomen der Zahl der Elektronen.
Im Periodensystem sind die Elemente von links nach rechts und oben nach unter nach steigender Ordnungszahl Z angeordnet. Die Ordnungszahl wird auch als Kernladungszahl oder Protonenzahl bezeichnet. Im Kern finden wir die positiv geladenen Protonen und die elektrisch neutralen Neutronen. Die Protonen wiegen jeweils etwa 1,672⋅10−27 kg. Neutronen haben eine Masse von 1, 674⋅10−27 kg und sind demnach etwa so schwer wie Protonen. Elektronen hingegen sind mit 9,109⋅10−31 kg wesentlich leichter. Protonen und Neutronen haben eine etwa 2000fach größere Masse als Elektronen.
Demmnach ist die Masse des Atoms fast vollständig im Kern vereint. Die sogenannte Massenzahl A ist die Summe aus der Ordnungszahl Z und der Neutronenzahl N:
$$A=Z+N$$
Ordnungszahl und Massenzahl können gemeinsam mit dem Element angegeben werden:
$$^A_ZSymbol$$
Das soll am Beispiel der natürlich vorkommenden Isotope des Kohlenstoffs beleuchtet werden, die alle die gleiche Anzahl an Protonen und Elektronen, aber unterschiedlich viele Neutronen aufweisen.
| Isotop | Protonen | Neutronen | Häufigkeit in % |
|---|---|---|---|
| \( ^{12}_6C \) | 6 | 6 | 98,9 |
| \( ^{13}_6C \) | 6 | 7 | 1,1 |
| \( ^{14}_6C \) | 6 | 8 | 10-10 |
Die Elemente sind in waagerechte Perioden und senkrechte Gruppen angeordnet. Die Hauptgruppen stehen zugleich für die Anzahl der Elektronen auf der äußersten Schale nach dem Bohrschen Atombau. So steht Sauerstoff in der VI. Hauptgruppe, hat also sechs Außenelektronen.
Aus der Periodennummer, also der Zeile, lässt sich direkt auf die Anzahl der besetzten Schalen schließen. Wenn wir beim Sauerstoff bleiben, einem Element der 2. Periode, können wir sagen, dass bei diesem Element zwei Schalen besetzt sind.
Die Schalen werden von innen nach außen mit den Buchstaben K, L, M, N, O, P und Q bezeichnet. Die K-Schale befindet sich dicht am Atomkern. Sie ist maximal mit lediglich zwei Elektronen besetzt. Auf die nächste Schale (L) passen bereits acht Elektronen und auf die M-Schale schon 18. Die maximale Anzahl der Elektronen auf einer Schale lässt sich mit2⋅n2 berechnen.
Für Chlor (17Cl) z.B. ergibt sich die Elektronenkonfiguration K2L8M7 und für Kalium (19K) die Konfiguration K2L8M8N1. Beim Edelgas Argon (18Ar) verteilen sich die Elektronen mit K2L8M8.
Alle Edelgase außer Helium besitzen acht Elektronen auf der Außenschale. Diese Konfiguration ist besonders stabil und man spricht auch von der Oktettregel. Beim Helium (2He) sind lediglich zwei Elektronen vorhanden. Hier gilt dann die Duplettregel. Oktettregel und Duplettregel werden zusammengefasst unter dem Begriff Edelgasregel zusammengefasst.
Elemente, die die Edelgaskonfiguration nicht aufweisen, können diese durch Elektronenabgabe oder -aufnahme und somit der Bildung von Ionen erreichen. So geben die Elemente der I. Hauptgruppe ein Elektron ab und K+ hat dann die Konfiguration K2L8M8N0 und somit die Konfiguration von Argon. Chlor hingegen nimmt ein Elektron auf, bildet also Cl– und lässt sich somit ebenfalls durch K2L8M8N0 beschreiben. Zwei Chloratome verbinden sich zu Cl2 und jedes Chloratom für sich erfüllt die Oktettregel:
Abbildung. Atommodelle von Chlor und Kalium.
Die folgende Tabelle zeigt die Elektronenkonfigurationen bis zur Ordnungszahl 20. Deutlich wird, dass die Schalen sukzessive aufgefüllt werden.
| Z | S | HG | P | K | L | M | N |
|---|---|---|---|---|---|---|---|
| 1 | H | I | 1 | 1 | |||
| 2 | He | VIII | 1 | 2 | |||
| 3 | Li | I | 2 | 2 | 1 | ||
| 4 | Be | II | 2 | 2 | 2 | ||
| 5 | B | III | 2 | 2 | 3 | ||
| 6 | C | IV | 2 | 2 | 4 | ||
| 7 | N | V | 2 | 2 | 5 | ||
| 8 | O | VI | 2 | 2 | 6 | ||
| 9 | F | VII | 2 | 2 | 7 | ||
| 10 | Ne | VIII | 2 | 2 | 8 | ||
| 11 | Na | I | 3 | 2 | 8 | 1 | |
| 12 | Mg | II | 3 | 2 | 8 | 2 | |
| 13 | Al | III | 3 | 2 | 8 | 3 | |
| 14 | Si | IV | 3 | 2 | 8 | 4 | |
| 15 | P | V | 3 | 2 | 8 | 5 | |
| 16 | S | VI | 3 | 2 | 8 | 6 | |
| 17 | Cl | VII | 3 | 2 | 8 | 7 | |
| 18 | Ar | VIII | 3 | 2 | 8 | 8 | |
| 19 | K | I | 4 | 2 | 8 | 8 | 1 |
| 20 | Ca | II | 4 | 2 | 8 | 8 | 2 |